新型生物脱氮工艺中 N2O 产生及释放研究进展
王 赛,王淑莹,巩有奎,彭永臻,张静蓉
(北京工业大学环境与能源工程学院,北京 100022)
摘 要:N2O 是重要的温室气体之一,微生物作用是大气中 N2O 的主要产生源。大量污水脱氮工艺的研究及应用表明,生物脱氮过程中 N2O 主要产生于微生物的硝化和反硝化代谢过程。近年来,许多新型生物脱氮工艺已逐步应用到实际污水处理中。本文阐述了硝化、反硝化阶段 N2O 的产生机理,并分析了传统生物脱氮工艺及同步硝化反硝化、短程硝化 - 反硝化、厌氧氨氧化、反硝化除磷等新型工艺中 N2O 的产生量及其影响因素,提出在追求高脱氮效率的同时,优化系统运行条件及种群结构,可在一定程度上降低系统 N2O 的产量及危害,为新型生物脱氮工艺实际运行过程中降低N2O 的产量提供参考。
关键词:N2O;产生机理;新型生物脱氮工艺
中图分类号:X703.1 文献标识码:A 文章编号:1000-3770(2010)03-0005-005
水体富营养化是当前全球重大的环境问题之一,生物脱氮除磷作为解决富营养化的手段已成为污水处理领域的研究热点。随着研究工作的不断深入,人们对脱氮除磷的微生物学机理有了新的认识, 开发了许多新型生物脱氮除磷工艺。在对新型脱氮工艺的研究中发现,污水生物脱氮过程中气态产物除N2 之外,还有 N2O 的积累与释放。N2O 是一种强力的温室气体,等摩尔浓度 N2O 的增温潜势是 CO2 的 200~300 倍[1]。N2O 在大气中不会下沉,不会被冲洗掉,其在对流层中很稳定,且可不断累积,停留时间长达 120 年[2]。据报道,N2O 的大气浓度每增加 1倍就将导致全球升温 0.3℃[3]。研究表明,污水生物脱氮过程是N2O 的重要产生源。新型生物脱氮工艺能够较为经济、有效地去除废水中的氮污染物,但是在解决水环境问题的同时,更应尽量避免随之产生的其它环境问题。因此,深入了解 N2O 在生物脱氮过程中的产生机制,以及不同生物脱氮工艺中 N2O 的释放量有着极为重要的理论及实际意义。
1 生物脱氮过程中N2O 产生的微生物学机理
现有的大量研究表明,污水生物脱氮过程中微生物的硝化及反硝化代谢过程是污水处理中 N2O的主要产生源。
1.1 硝化过程
刘秀红等[4]的研究发现,硝化作用是生物脱氮中产生 N2O 的主要来源。生物硝化过程包括 2 个阶段:第 1 个阶段是氨氮在氨氧化菌(Ammonia-oxi- dizing bacteria,AOB) 的作用下氧化为亚硝酸盐(NO -),羟胺(NH OH)是该反应过程的中间产物,起 催 化 作用的酶有氨单加氧 酶(Ammonia mono-oxygenase,AMO) 和羟胺氧化还原酶(Hy- droxylamine oxidoreductase,HAO);第 2 个阶段是经亚硝酸盐氧化 菌 (Nitrite-oxidizing bacteria, NOB)氧化为硝酸盐(NO -),起催化作用的酶是亚硝酸氧化还原酶(Nitrite oxidoreductase,NOR)。
N2O 是作为硝化阶段首过程的副产物出现的。在正常的硝化反应阶段,N2O 可能产生的途径有 2 个:(1) 亚硝酸盐在 NOR 作用下的还原反应,即硝化菌的反硝化作用。当溶解氧受限制时,硝化反应无法进行彻底,导致亚硝酸盐的积累,硝化菌利用氨氮氧化过程中提供的电子经异化还原反应将其转化为 N2O 而释放[5]。(2)亚硝酸盐或氨氧化中间产物羟胺的化学分解作用[6]。
在硝化阶段,除自养型硝化菌作用之外,许多异养微生物也可以进行硝化作用。异养硝化菌的硝化速率是自养菌的 1/(100~1000)倍,而且只有在较高的有机物负荷(COD/N>10)和低 DO 下才能占优势起到硝化作用[7]。尽管如此,Anderson[8]的研究表明,在纯菌种培养试验中,异养硝化菌 A aecalis 硝化过程产生的N2O 比自养菌 N europaea 产生的多。除此之外,好氧反硝化菌也可能产生 N2O,Inamori 等[9]认为 A faecalis 能在好氧反硝化的过程中产生 N2O。
1.2 反硝化过程
反硝化是由异养型兼性厌氧微生物将硝酸盐或亚硝酸盐还原为氮气的过程。传统的反硝化按照 4 个阶段进行,如图 1 所示。

可以看出,N2O 是反硝化过程的中间产物。由于 NO 有剧毒,以NO 为产物的细菌难以生存,因此,产生的 NO 会快速转化为 N2O[10]。在不同反应条件下,N2O 和 N2 都有可能作为反硝化的最终产物释放。能否控制并保持氧化亚氮还原酶(Nos)的活性是抑制N2O 产生的关键。研究发现,系统中低 DO,亚硝酸盐的积累,低 pH 等环境因素都会抑制 Nos 的活性而导致N2O 的积累与释放[11-13]。除此之外,低 COD/N 比导致不完全反硝化也是产生 N2O 的重要原因。
在脱氮过程中,除了硝化和反硝化作用产生 N2O 外,还会发生异化性硝酸盐还原作用(DNRA)。该过程中,亚硝酸盐和硝酸盐可用作电子受体还原成氨。该作用常发生在电子受体贫乏的缺氧环境中[14]。对该过程起催化作用的是硝酸盐还原酶(Nar)和亚硝酸盐还原酶(Nir)。Bleakley 等[15]在研究中发现异化性硝酸盐还原作用能产生 N2O,硝酸盐呼吸细菌的增长十分迅速,是一类不属于反硝化菌的产 N2O 菌群。因此,生物脱氮过程中 N2O 的产生不仅仅局限于传统脱氮过程,微生物的多样性使得 N2O 的来源更多,产生机理更加复杂。
2 不同污水脱氮工艺中 N2O 的产生分析
全程硝化 - 反硝化工艺是目前污水处理厂应用较多的生物脱氮工艺。近年来,许多新型生物脱氮工艺:同步硝化 - 反硝化,短程硝化 - 反硝化及厌氧氨氧化等工艺的研究与开发,使得经济高效地去除污水中的含氮污染物成为可能。但是,研究表明,在不降低脱氮效率的前提下,新型生物脱氮工艺可能会导致 N2O 产量的增加。因此,在关注这些新技术、新工艺脱氮效率的同时,也应该关注其排放产物对大气环境的影响。
2.1 全程硝化 - 反硝化工艺
该工艺在好氧条件下, NH + 首先被 AOB 氧化成 NO - 再被 NOB 氧化成 NO -,在缺氧条件下,NO -被还原为 N2。
在硝化阶段,DO 对 N2O 的产生与释放有重要的影响,高 DO 浓度有利于降低 N2O 产生量,当 DO 质量浓度低于 0.9 mg·L-1 时,将导致 N2O 产生量的迅速升高[16]。Galle Tallec 等[17]研究发现DO=1 mg·L-1时,氧化亚氮产生率较高(7.1 μg·g-1SS·h-1)。低 DO导致 N2O 较高的原因是:AOB 在低 DO 下可能进行反硝化作用。该过程中,NO - 取代氧作为电子受体。另外,氨氮对 NOB 有抑制作用,若氨氮浓度过高,容易造成亚硝酸盐的积累,使 N2O 产量增加[18]。这也是传统脱氮工艺不适合处理高浓度氨氮废水的原因。
反硝化过程中 C/N 比是系统中 N2O 产生的重要因素。Sunjin Hwang 在研究中发现,当 C/N 比为 3 时,好氧和缺氧反应器中都没有发现 N2O 的释放, 但当 C/N 比由 3 降低到 2 时,缺氧系统中产生了质量浓度为 130 mg·L-1 的 N2O [19]。原因可能是碳源不足,导致反硝化不彻底,N2O 成为反应的产物。 Hanaki 等[13]指出当 C/N 比迅速下降时,反硝化阶段有大量的 N2O 释放。Itokawa[20]的研究中,C/N 比低于 3.5,有 20%~30%的氮以 N2O 的形式排放。另外,系统中溶解氧的存在会导致 N2O 的产生[5]。
从实现 N2O 减量化的角度出发,在硝化阶段应保持较高的溶解氧,较低的氨氮负荷,以减少亚硝酸盐的积累;反硝化阶段避免溶解氧的存在,C/N 比应大于 3.5。除此之外,较大的 SRT(> 10 d)和适当的pH(6.8~8)也可以减少 N2O 的产生[5]。
2.2 同步硝化反硝化
同步硝化反硝化(Simultaneous nitrification and denitrification,SND)脱氮是在好氧状态下硝化和反硝化在一个反应器内同时进行的过程。关于同步硝化反硝化产生的机理,广泛接受的解释有以下 2 种:存在的条件下直接把氨氮转化为气态产物去除,许多异养硝化菌也能进行好氧反硝化。因此,从微生物学角度来看同步硝化反硝化生物脱氮是可能的。
Zeng 等[25]在 SBR 系统中,控制 DO 质量浓度在 0.5 mg·L-1,通过中间产物 NO - 的积累,成功实现了 SND,经测定系统释放的气体大部分是 N2O 而不是 N2。Beline 等[26]在低氧条件下实现了同步硝化反硝化,用 15N 示踪技术发现反硝化产生的 N2O 占总氮的 27%,是同步硝化反硝化 N2O 产生的主要过程。吕锡武运用 SBR 反应器,将同步硝化反硝化与传统硝化反硝化工艺进行了对比,在总氮去除率相差不大的前提下,同步硝化反硝化产生的 N2O 比传统工艺少,后者是前者的 1.5 倍[27]。在实现同步硝化反硝化的运行条件方面,C/N 比小于 4,DO 质量浓度浓度大于 2 mg·L-1,都会增大 N2O 的产生量[28]。
2.3 短程硝化 - 反硝化工艺
短程硝化反硝化工艺是将硝化反应控制在亚硝酸盐阶段,直接进行反硝化反应(见图 2)。与全程脱氮相比,短程工艺能节省 25%的氧消耗量和 40% 的外碳源消耗量。但是,在对 N2O 产生量的研究方面却不容乐观,这对在全球采用新工艺处理污水的形势下提出了一个亟待解决的问题。
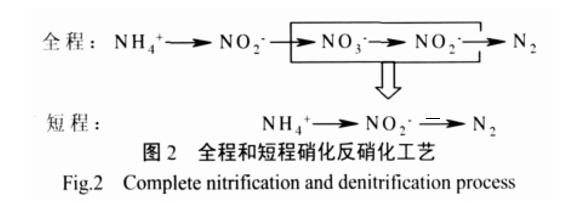
根据现有的研究结论可知,亚硝酸盐的积累是短程硝化 - 反硝化阶段 N2O 产生较多的主要原因。M J Kampschreur [21]认为,短程硝化阶段 N2O 产生的主要来源是 AOB 的反硝化作用。硝化过程中亚硝酸盐的积累会导致 AOB 以亚硝酸盐为电子受体进行反硝化,导致 N2O 的积累与释放。有报道称,亚硝酸盐的积累是反硝化过程产生 N2O 的重要原因,当NO - 质量浓度 ρ(N)=1 mg·L-1 时就会对 N O 的还原产生抑制[13]。Lemaire R[22]也有类似的研究,抑制N2O 还原的 NO - 质量浓度 ρ(N)=5 mg·L-1。但刘秀红[4]发现,短程脱氮过程中 N2O 主要产生在硝化阶段,反硝化阶段不但没有 N2O 产生,硝化阶段积累的溶解性 N2O 反而会进一步还原为 N2。Yan Zhou [23]研究结果表明,反硝化中抑制 N2O 还原的是游离亚硝酸(Free nitrous oxide,FNA),而不是亚硝酸盐。当 FNA 质量浓度ρ(NO --N)=0.000 7~0.001 mg·L-1 时,抑制作用为 50%;当 FNA 质量浓度大于 0.004 mg·L-1时,其对N2O 的还原完全抑制。有关于亚硝酸盐对N2O 还原的抑制作用还需要进一步的研究。
短程脱氮过程中,氨氮负荷的增加,水力停留时间(HRT)的减少,盐度的增加,DO 的降低都会导致亚硝酸盐的积累,是 N2O 产生的间接因素;而在短程反硝化阶段,即使 C/N 比降到 0.5,也没有发现 N2O 的增加 [17],这说明 C/N 比并不是短程脱氮中N2O 积累的主要因素。
2.4 厌氧氨氧化工艺
研究发现,氨的氧化可在无氧但存在硝酸盐或亚硝酸盐的情况下发生。以硝酸盐或亚硝酸盐为电子受体,氨作为直接电子供体,还原硝酸盐或亚硝酸氮并将其转化为氮气的反应(见图 3),称为厌氧氨氧化(ANAMMOX)。
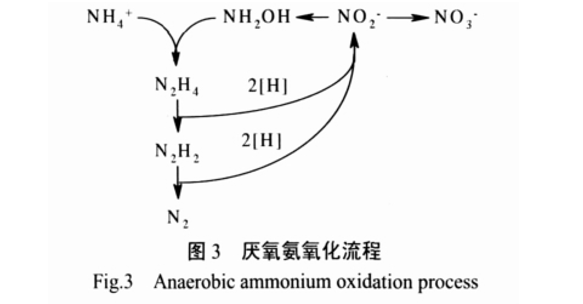
Voets 等运用硝化- 厌氧氨氧化 2 个反应器进行研究,发现厌氧氨氧化反应器中 N2O 占进水总氮的0.6%,由于厌氧氨氧化菌没有发现有产生 N2O 的生理功能,因此推测是硝化段中的氨氧化细菌进入到厌氧氨氧化反应器中发生反硝化的结果[29]。Kartal 等[30] 的研究证明厌氧氨氧化菌在还原硝态氮时,并不经过传统的产生N2O 的反硝化过程。只有质量分数 0.26% 的氮以N2O 的形式释放,对此合理的解释是 N2O 来自NO 的去毒作用,NO 是厌氧氨氧化的中间产物;另一种可能是产生于羟胺的氧化还原作用。
与传统的硝化 - 反硝化脱氮过程相比,短程硝化-ANAMMOX 脱氮过程可使运行费用减少90%,不产生 N2O 气体,具有显著地可持续性和高经济效益的特点[31]。因此,短程硝化-ANAMMOX 工
艺具有较高的开发价值和良好的应用前景。
2.5 反硝化除磷工艺
反硝化除磷是利用反硝化除磷细菌 (DPB)以硝酸盐代替氧作为电子受体将反硝化脱氮和生物除磷两个原本彼此独立的过程合二为一。反硝化除磷解决了城市污水 C/N 比较低的环境下反硝化与除磷竞争有限碳源的矛盾,具有“一碳两用”的优势; 而缺氧代替好氧则节省了曝气的能量消耗,同时减少了污泥产量。
系统中共同存在时,大部分的反硝化是由反硝化聚糖菌完成的,当NO - 质量浓度ρ(N)高于1~2 mg·L-1 时会产生 NO -,原因可能是 NO - 的积累抑制了 N O还原酶的活性[32]。Lemaire[33]的研究也有类似的结 论,在反应过程中,聚糖菌而不是聚磷菌进行反硝化作用,并且释放的气体以 N2O 为主,在将反硝化聚磷的污泥和反硝化污泥混合并加入外碳源后,N2O的释放量迅速减少。目前,对反硝化吸磷过程中产生气体的分析比较少,对此工艺中 N2O 的产生还需进一步的研究。
2.6 好氧脱氮工艺
好氧脱氮工艺是 1997 年首先由德国 Hannover 大学提出的新型生物脱氮工艺[34]。在许多实际生物脱氮系统中,经常会出现氨的超量去除,这种氨和硝酸盐的超量去除现象称为好氧脱氮。Muller[35]研究 发现,好氧反硝化速率与氨消耗速率基本处于同一数量级,这使好氧反硝化更具有实际的工程意义。其发生地可能条件有以下几点:(1) 一些硝化细菌除了能够进行正常的硝化作用外,还能进行反硝化作用。(2)一些反硝化细菌除了能在无氧条件下进行正常的反硝化作用外,还能在有氧条件下进行反硝化作用(即当氧受限制时,同时以氧和硝酸盐作为电子受体)。(3)还有一些细菌能彼此合作,进行序列反应,把氨转化为氮气[36]。
虽然好氧反硝化工艺可在 DO 较高的条件下进行 ,但 N2O 释放量远高于低 DO 条件下 N2O 的释放量[37]。Inamori 等[9]认为好氧反硝化菌在好氧条件下还原硝酸盐生成的 N2O 比在缺氧条件下多得多,但是也有报道称纯好氧反硝化菌株的产 N2O 量低于传统反硝化菌[38]。目前好氧反硝化菌对 N O 的贡献还没有统一的定论。

3 结 论
微生物的硝化和反硝化是污水脱氮过程中产生N2O 的 2 个主要阶段。其产生机理并没有统一的结论。基于传统脱氮工艺理论基础上开发的各种新型脱氮工艺已逐渐运用于实际污水处理中。研究发现, 新型的脱氮工艺虽然在脱氮效率,运行费用上较传统工艺占优势,但在温室气体 N2O 产生方面却不容乐观。因此,研究及实际应用过程中应避免走进一味追求高脱氮效率的误区。
在生物脱氮的过程中,运行条件和微生物群落对N2O 的产量起到关键性的作用。N2O 的减量化应该从这两个方面进行。通过优化系统运行条件,可有效降低生物脱氮过程中 N2O 的释放量;同时,优化微生物种群结构,减少系统中以 N2O 作为最终产物的菌群数量也可实现 N2O 的减量化。目前,类似研究在实际工程中的应用并不多见。在全球日趋变暖的大形势下,如何将污水处理中释放的 N2O 减量是今后研究的一个主要方向,也是对科研工作者提出的一大挑战。
参考文献:
[1] 石明岩,吕锡武,稻森悠平.N2O 的环境效应及其防治技术的发展趋势[J].城市环境与城市生态,2002,15(5):45-47.
[2] Sharma C, Gupta P K, Parashar D C.Atmospheric nitrous oxide: sources and sinks [J]. Tropical Ecology, 1996, 37(2):153-166.
[3] 高素华,潘亚茹.温室效应对气候和农业的影响[J].环境科学,
1991, 12(2):73-76.
[4] 刘秀红,彭永臻,马涛,尚会来,吴昌永.硝化类型对污水脱氮过程中N2O 产生量的影响[J].中国环境科学,2007,27(5):633-637.
[5] 尚会来,彭永臻,王淑莹,等.污水生物脱氮过程中N2O 的产生和减量化控制[J].中国给水排水,2008,24(16):104-108.
[6] M D Butler, Y Y Wang, E Cartmell, et al. Nitrous oxide emissions for early warning of biological nitrification failure in activated sludge [J].Water Research, 2009, 43(5), 1265-1272.
[7] Van Niel E W J, Arts P A M, Wesselink B J, et al. Competition between heterotrophic and autotrophic nitrifiers for ammonia in chemostat cultures [J].FEMS Microbiology Ecology,1993,102 (2), 109-118.
[8] Anderson I C, Poth M, Homstead J, et al. A comparison of nitric oxide and nitrous oxide production by the autotrophic nitrifier Ni- trosomonas europaea and the heterotrophic nitrifier Alcaligenes faecalis [J]. Applied and Environmental Microbiology, 1993, 59 (11), 3525-3533.
[9] Inamori Yuhei,Wu Xiao-Lei,Mizaochi Motoyuki.N2O producing capability of nitrosomonas europaea,nitrobacter winograski and alcaligenes faecalis [J].Water Science and Technology,1997,36 (10):65-72.
[10] 刘秀红,杨庆,吴昌永,等.不同污水生物脱氮工艺中 N2O 释放量及影响因素[J].环境科学学报,2006,26(12):1940-1947.
[11] Gaelle Tallec, Josette Garnier, Gilles Billen, et al. Nitrous oxide e- missions from denitrifying activated sludge of urban wastewater treatment plants, under anoxia and low oxygenation [J].Biore- source Technology,2008,99(7):2200-2209.
[12] Asma Alinsafi, Nouceiba Adouani, Fabrice Beline, et al. Nitrite effect on nitrous oxide emission from denitrifying activated sludge [J]. Process Biochemistry, 2008(43):683-689.
[13] Hanaki K, Hong Z, Matsuo T. Production of nitrous oxide gas during denitrification of wastewater [J]. Water Science and Tech- nology, 1992, 26(5-6):1027-1036.
[14] Bonin P, Gilewicz M, Bertrand J C. Effect of oxygen on each step of denitrification on Pseudomonas nautica [J]. Canadian Journal of Microbiology, 1989, 35(11), 1061-1064.
[15] Bleakley B H, Bruce H, Tiedje J M. Nitrous oxide production by organisms other than nitrfiers or denitrfiers [J].Applied and Envi- ronmental Microbiology, 1982, 44 (6), 1342-1348.
[16] 刘秀红,彭轶,马涛,等. DO 浓度对生活污水硝化过程中 N2O 产生量的影响[J].环境科学,2008,29(3):660-664.
[17] Galle Tallec, Josette Garnier, GillesBillen, et al. Nitrous oxide e- missions from secondary activated sludge in nitrifying conditions of urban wastewater treatment plants: effect of oxygenation level [J].Water Research, 2006, 40(15):2972 - 2980.
[18] 赵宗升,刘鸿亮,李炳伟,等.高浓度氨氮废水的高效生物脱氮途径[J].中国给水排水,2001,17(5):24-28.
[19] Sunjin Hwang, Kwangun Jang, et al. Factors affecting nitrous ox- ide production: a comparison of biological nitrogen removal pro- cesses with partial and complete nitrification [J].Biodegradation,
2006, 17(1):19-29.
[20] Hiroki Itokawa, Keisuke Hanaki, Tomonori Matsuo. Nitrous ox- ide production in high-loading biological nitrogen removal pro- cess under low COD/N ratio condition [J]. Water Research, 2001, 35(3), 657-664.
[21] Marlies J Kampschreur, et al. Dynamics of nitric oxide and nitrous oxide emission during full-scale reject water treatment [J]. Water Research, 2008, 42(3):812-826.
[22] Lemaire R, Meyer R, Taske A, et al. Identifying causes for N2O accumulation in a lab-scale sequencing batch reactor performing simultaneous nitrification, denitrification and phosphorus removal [J]. Journal of Biotechnology, 2006, 122(1):62-72.
[23] Yan Zhou, Maite Pijuan, Raymond J, et al. Free nitrous acid inhi- bition on nitrous oxide Reduction by a denitrifying-enhanced bio- logical phosphorus removal sludge [J].Environmental Science & Technology,2008,42(22),8260-8265.
[24] 蒋胜韬,王三秀,万金保.同步硝化反硝化研究进展[J].江西科学,2008,26(6):905-909.
[25] Zeng R J ,van Loosdrecht M C M,Yuan Z G, et al. Metabolic model for glycogen accumulating organisms in anaerobic/ aerobic activated sludge systems[J]. Biotechnology and Bioengineering, 2003, 81(1):92-105.
[26] F Beline, J Martinez, C.Marol, et al. Application of the 15N tech- nique to determine the contributions of nitrification and denitrifi- cation to the flux of nitrous oxide from aerated pig slurry[J].Water Research,35(11):2774-2778.
[27] 吕锡武,稻森悠平,等.同步硝化反硝化脱氮及处理过程中 N2O的控制研究[J].东南大学学报,2001,31(1):95-99.
[28] 阮文权,陈坚.好氧颗粒污泥同步硝化反硝化脱氮过程中 N2O的产生[J].无锡轻工大学学报, 2004,23(4) :37-40.
[29] Voets J P. Removal of nitrogen from highly nitrogenous wastewater [J].Journal Water Pollution Control Federation,1975,47(2):394-398.
[30] Kartal B, Kuypers M M M, Lavik G Schalk J, et al. Anammox bacteria disguised as denitrfiers: nitrate reduction to dinitrogen gas via nitrite and ammonium [J].Environmental Microbiology, 2007, 9(3), 635-642.
[31] 陈旭良.短程硝化- 厌氧氨氧化工艺处理味精废水的研究[D].杭州:浙江大学,2006.
[32] Zeng R J, Yuan Z, K eller J, et al. Enrichment of denitrifying glycogen accumulating organisms in anaerobic/anoxic activated sludge system [J].Biotechnology and Bioengineering,2003,81(4) : 397-404.
[33] Romain Lemaire, et al. Identifying causes for N2O accumulation in a lab-scale sequencing batch reactor performing simultaneous
nitrification, denitrification and phosphorus removal[J].Journal of Biotechnology,2006,122(1):62-72.
[34] Hippen A, Baumgarten G, Rosenwinkel K-H, et al. F.Aerobic
deammonification-A new experience in the treatment of wastewa- ter. Water Science and Technology, 1997, 35(10):111-120.
[35] Muller E B, et al. Simultaneous NH3 oxidation and N2 production at reduced O2 tensions by sewage sludge subcultured with chemolithotrophic medium [J].Biodegradation,1995,6(4):339-349.
苏州湛清环保科技有限公司
热线:400-110-8500
传真:0512-50310052
邮箱:sales@drtsing.com
地址:江苏省苏州市昆山市玉山镇台虹路19号